プローブ型ラマン分光装置 All-In-One®の分析事例
TECHNICAL INFORMATION
技術情報
2022.09.26
ラマン分光器
テーマ:
プローブ型ラマン分光装置 All-In-One®の分析事例
本稿ではMarqmetrix社製プローブ型ラマン分光器All-In-One®を用いて、医薬品分析事例を紹介する。また原薬を使ってCoherent社製低波数ラマンモジュールの特徴と有用性を紹介する。
In this paper, we introduce a case study of drug analysis using a probe-type Raman spectrometer All-In-One manufactured by Marqmetrix. In addition, we introduce the characteristics and usefulness of Coherent's low-wavenumber Raman module using the drug substance.
1.はじめに
ラマン分光法は化合物に単波長の光を照射し,入射光と散乱光の振動数の差として現れるラマン散乱を測定する手法である。得られるスペクトルは化合物の分子構造(官能基),コンフォメーション,化学結合および水素結合等を反映し,同じく振動分光法である赤外吸収スペクトルと同様に,物質の同定に用いられている。(1)また試料の前処理の必要がなく非破壊・非接触で測定できる分析法である。(2)この特徴を生かして医薬品分野において本法は錠剤中の有効成分含量の定量(3),原薬の結晶多形の評価(4),製造中の原薬の晶析反応解析(5)さらに、原料・添加剤の受入れ確認試験など研究開発から品質管理にいたる広範囲に用いられる分析技術となりつつある。本稿ではMarqmetrix社製プローブ型ラマン分光装置All-In-One®とCoherent社製低波数ラマンモジュールを用いて原薬,モデル錠剤を用いて装置および分析手法の有用性と実用性を紹介する。
2.装置の概要



図1にAll-In-One®(以降、本装置)の概要、表 1, 2に装置の主要な仕様を示す。本装置は,プローブ部(a),モニター部(b),レーザーや光学部品を含んだベースユニット部(c)そしてマウス(d),キーボード(e)で構成されている。コンピュータを内蔵したベースユニットは幅,奥行きともに25 cm以内と非常にコンパクトで,測定場所への移動も簡単である。搭載しているレーザーは励起波長785 nm,出力は5~450 mWの間で可変である。内蔵しているコンピュータには128 GBの記憶容量やUSB,インターネット接続用コネクターなども搭載されている。本装置には直径1/2インチのプローブが標準装備されており,反応容器や測定対象物の大きさ,目的に応じて1/4インチ,1/8インチなどの異なる外径のプローブやフロー型プローブなどもオプションとして用意されている。
3.応用例
3-1.錠剤中に含まれる有効成分の評価
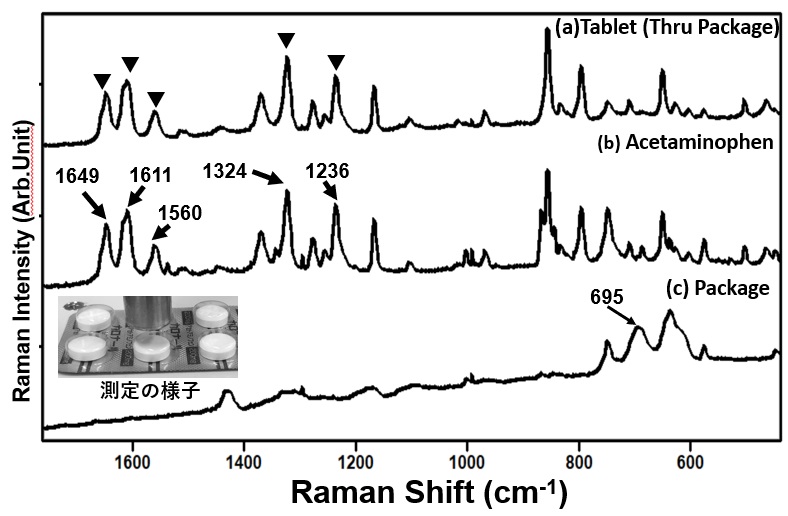
本装置に付属する1/2インチラマンプローブの焦点距離は約5 mmであり,これを用いればパッケージから錠剤を取り出さず,錠剤のラマンスペクトルを測定することが可能である。分析例として,CALONAL®錠剤パッケージに入れた状態でラマンスペクトルを測定し,パッケージの影響,有効成分の確認・評価を行った。 図2にCALONAL®錠剤(以降,錠剤と呼ぶ),錠剤の有効成分であるアセトアミノフェンおよびパッケージのみのラマンスペクトルを示す。錠剤(図2 (a))とアセトアミノフェンのラマンスペクトル(図2(b))に1649,1611,1560,1324そして1236 cm-1にアセトアミノフェン由来の特異的なピークを確認できる。(6)図2(c)のパッケージのみのラマンスペクトルは,ラマン散乱強度の中程度であり,アセトアミノフェン由来のピークに重複しないパッケージ由来のピークを695 cm-1に認めた。
3-2.錠剤中の有効成分の定量
プロセスの工程管理とくに有効成分の定量では近赤外分光法が有効であるとの報告(7)もあるが,不均一に分散した有効成分の定量的な評価が困難であるとの報告もある。(8)そこで測定可能面積の異なる広域型ラマンプローブと標準プローブから得られたラマンスペクトルから錠剤中のそれぞれの有効成分の検量線構築・比較することにより広域型ラマンプローブの有用性や実用性の評価・検討を実施した。
実験に用いた試料および装置

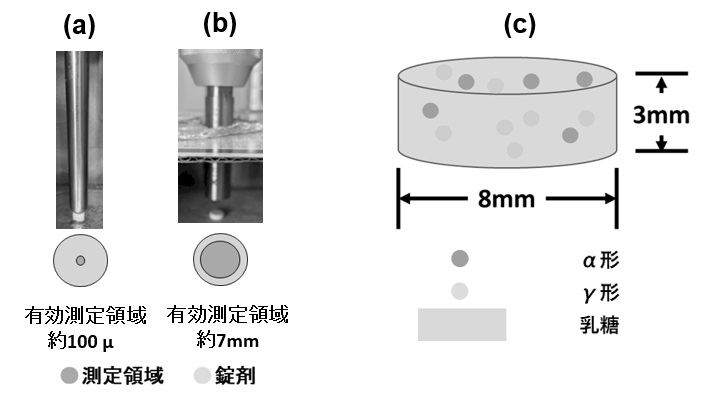
本実験では有効成分としてインドメタシン20%と添加剤として乳糖80%を含有したモデル製剤を準備した。インドメタシンの結晶形(α,γ)の含有量を変化させて有効成分と添加剤を物理的混合し,錠剤成型器で錠剤を準備した。(表3) 頻用されている外径1/2標準プローブと広域型プローブを使って得られた検量線のR2乗値を使って広域型プローブの有用性を評価した。図3に実験に測定領域と試料イメージを示す。
測定条件および解析
すべての錠剤の測定には同じ測定条件を用いた。スペクトル測定には励起レーザー波長が785nmを搭載したAll In One® (Marqmetrix Inc. WA U.S.A.)を用い,スペクトル分解能は6cm-1,露光時間は0.1秒で積算回数は10回とした。また測定領域は100~3200cm-1である。ベースライン補正などのデータ処理とPLS2解析にGrams AIとIQ バージョン9.3(Thermo Fisher Scientific Inc.MA U.S.A.)を使用した。解析領域は1726~1550cm-1でバリデーションにLeaveOneOutを採用したPLS2を使って検量線を得た。
結果と考察
-
インドメタシンのラマンスペクトル
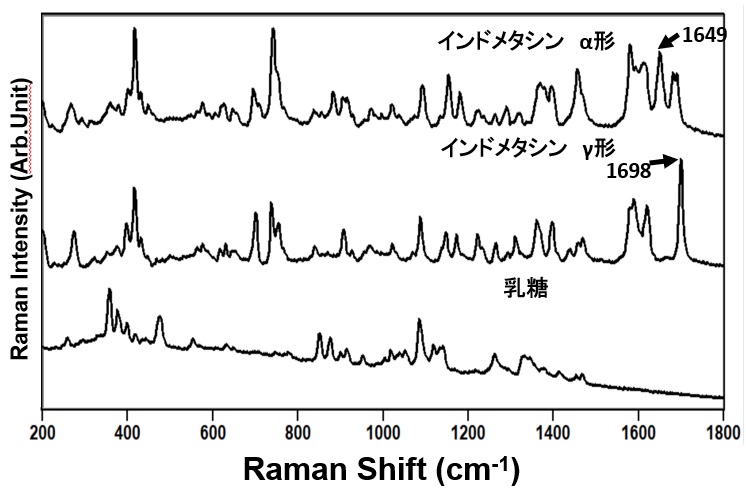
図4 モデル製剤の各成分のスペクトル
インドメタシンのα,γ形と乳糖のラマンスペクトルを図4に示す。インドメタシンには1726~1550cm-1の領域で複数のピークを確認できるが乳糖にはない。さらにα形は1649cm-1にγ形には1698cm-1に特異的なピークがあり結晶間でラマンスペクトルの差異も確認した。(9) -
検量線のバリデーション
PLS2解析から得られたFactorLoadingと参照スペクトルのピーク位置や強度を比較することによりFactorLoading1(主成分1)はα形そしてFactorLoading 2(主成分2)はγ形であることを確認している。(10) -
検量線の比較
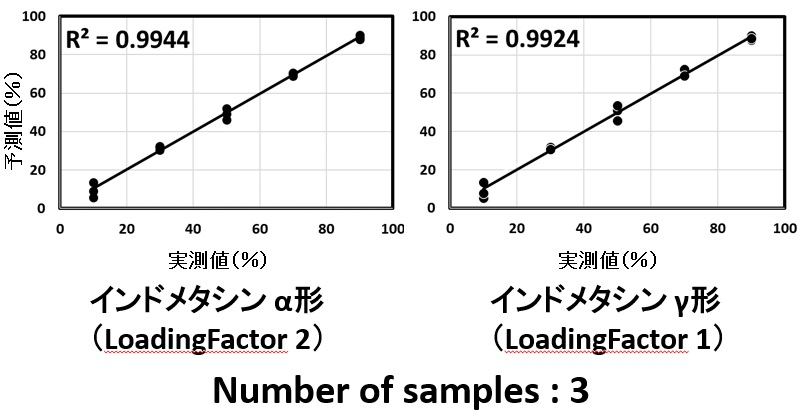
図5 各成分の検量線(広域型プローブ) 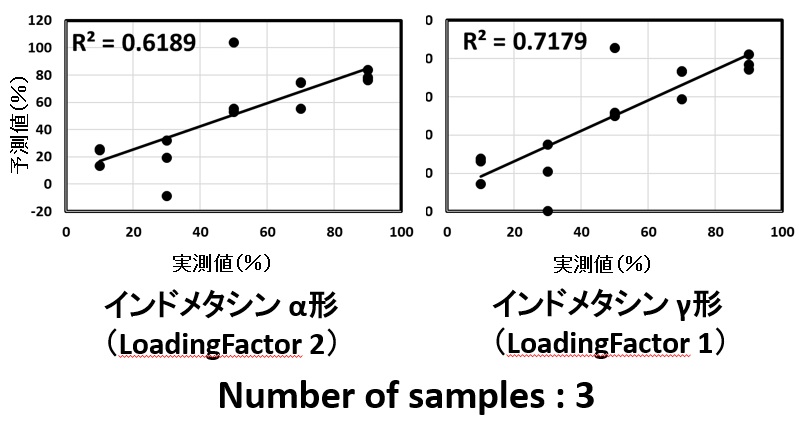
図6 各成分の検量線(1/2標準プローブ)
PLS解析から得られたα形,γ形の検量線の精度は広域型においては,R2値は0.9944と0.9924(図5)であった一方,1/2インチ標準プローブでは0.6189と0.7179であり(図6),両者のR2値に明瞭な違いを認めた。また広域型ではサンプル数(n数)を変化させてもR2乗値違いは微弱であった。(表4)
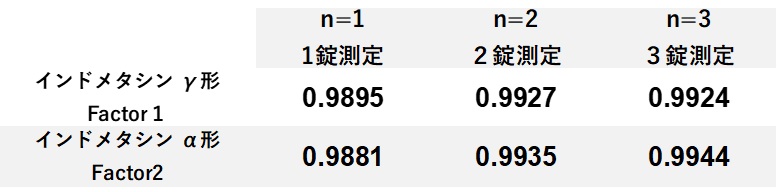
表4 検量線の精度と試料数の関係
4.Coherent社製低波数ラマンモジュール
4-1.装置の概要
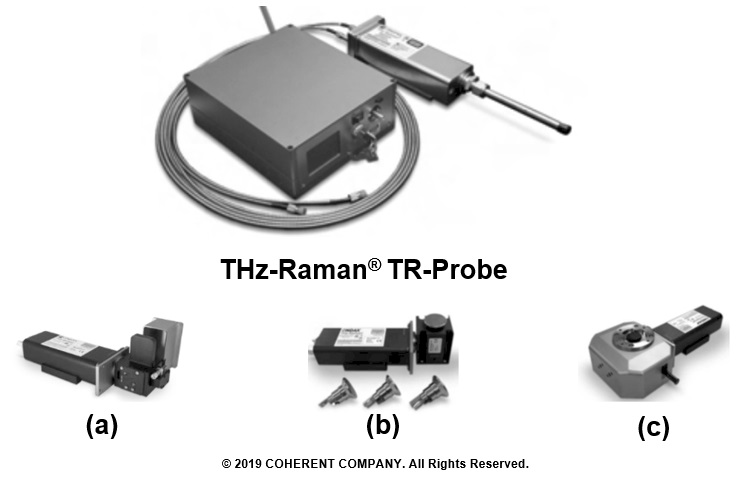
図7にTHz-Raman® TR-Probeおよびその付属品の外観を示す。THz-Raman®TR-Probe本体(図7 a),バイアル瓶に充填した試料測定を可能にするモジュール(図7 b),試料の透過測定を可能にする透過モジュール(図7 c)そして顕微鏡に搭載可能な顕微鏡モジュール(図7 d)などTR-Probeにはマクロ分析からミクロ分析まで広範囲の応用をカバーするアクセサリーを搭載することが可能である。
4-2.結晶多形の識別
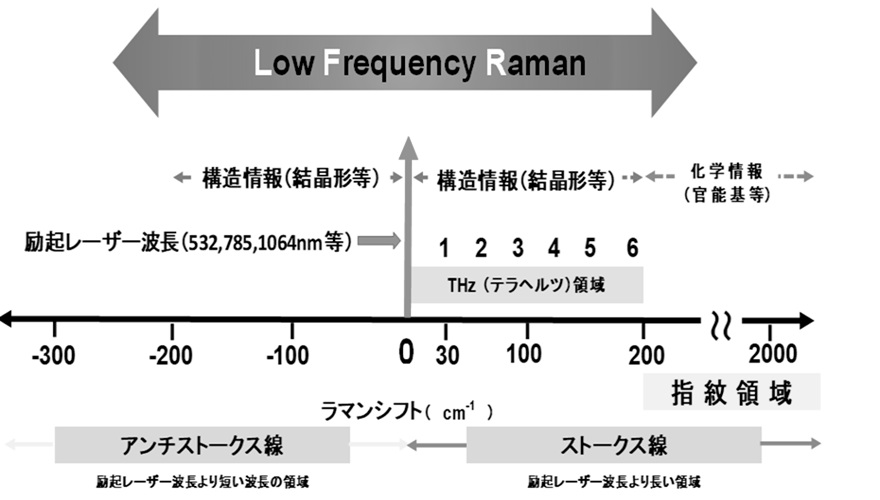
図8に低波数領域ラマン分光法と測定領域を示す。物質の分子構造-官能基、幾何異性、コンフォメーション、水素結合、化学構造の状態などは指紋領域と呼ばれている200~1800cm-1にピークが現れ,(11)200 cm-1以下の領域を低波数領域と呼び,化合物の結晶形など構造情報を表すピークが現れる。低波数領域では指紋領域のラマン散乱光強度より強くなることが知られている。(12)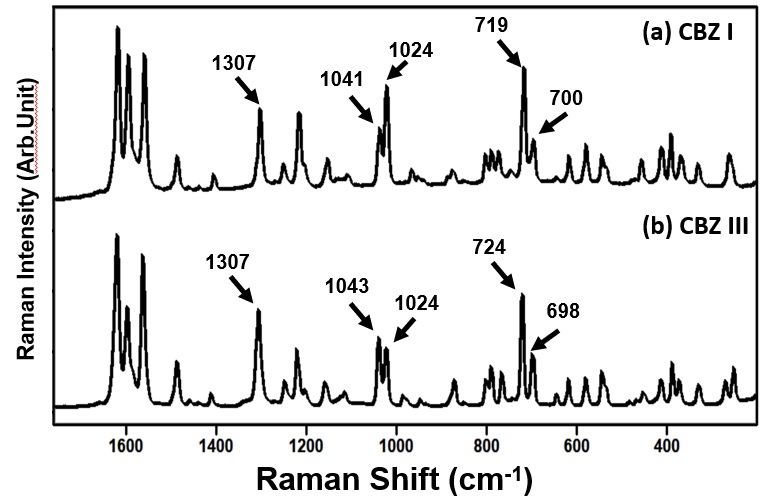
図9 カルバマゼピンのスペクトル(通常領域)
そこでカルバマゼピン(以降CBZと呼ぶ)のI形,III形結晶をモデル原薬として選択し,指紋領域と低波数領域のラマンスペクトルを用いて識別性を比較した。図9にCBZのI形(図9 a),III形(図9 b)の指紋領域のラマンスペクトルを示す。CBZ I形結晶には1307,1041,1024,719そして700 cm-1に比較的強度の強いラマン散乱ピークを確認できる。CBZ III形には1307,1043,1024,724そして698 cm-1に同様に散乱強度が強いピークを確認できた。(13)強度が強いピーク位置をI,III形間で比較したところ,1300 cm-1付近のピークは1307 cm-1と同じ位置にピークがあるなどピーク位置と強度の違いは微細であり化学組成が同じI,III形結晶のラマンスペクトルは酷似しており識別は困難であった。
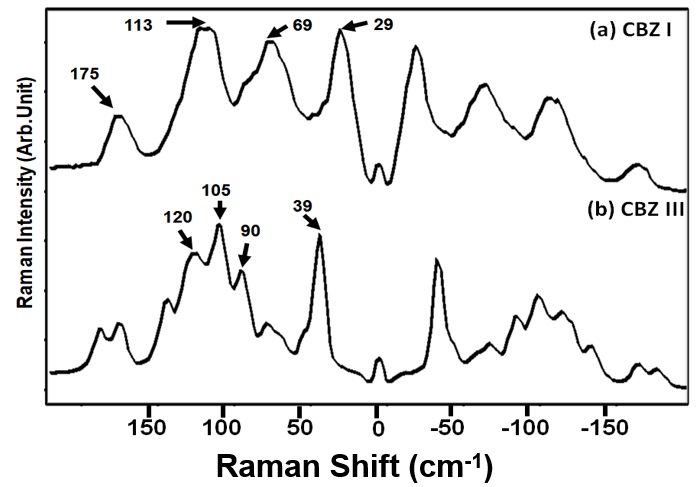
図10に低波数領域のCBZ I形 (図10 a),III形 (図10 b)のラマンスペクトルを示す。CBZのI形には29,69,113そして175 cm-1にラマン散乱強度の強いピークを認め,(10),III形には39,90,105そして120 cm-1にピークを認めた。(14)低波数領域ラマンスペクトルを用いればCBZの結晶多形のスペクトル間に明瞭な違いを確認した。
5.おわりに
Marqmetrix社製All-In-One®を用いてパッケージ中の錠剤中の有効成分の評価や検量線精度は測定面積を広げることで改善できることを示した。さらにCoherent社製低波数ラマンモジュールを用いて結晶多形の識別を高い精度で実施できることも確認した。
謝辞
試料を提供および実験に協力頂いた明治薬科大学分子製剤学研究室に感謝する。
参考文献
(1)久田浩史, et al. "日本薬局方の医薬品各条における確認試験を志向したラマン分光法の実用性." 製剤機械技術学会誌= Journal of pharmaceutical machinery and engineering 27.1 (2018): 5-12.
(2)Kim, Minjung, et al. "A new non-invasive, quantitative Raman technique for the determination of an active ingredient in pharmaceutical liquids by direct measurement through a plastic bottle." Analytica chimica acta 587.2 (2007): 200-207.
(3)Noonan, Kathryn Y., et al. "Rapid classification of simulated street drug mixtures using Raman spectroscopy and principal component analysis." Applied Spectroscopy 63.7 (2009): 742-747.
(4)Lipiäinen, Tiina, et al. "Direct comparison of low-and mid-frequency Raman spectroscopy for quantitative solid-state pharmaceutical analysis." Journal of pharmaceutical and biomedical analysis 149 (2018): 343-350.
(5)Ono, T., J. H. Ter Horst, and P. J. Jansens. "Quantitative measurement of the polymorphic transformation of L-glutamic acid using in-situ Raman spectroscopy." Crystal Growth & Design 4.3 (2004): 465-469.
(6)Shende, Chetan, et al. "Drug stability analysis by Raman spectroscopy." Pharmaceutics 6.4 (2014): 651-662.
(7)De Beer, Thomas, et al. "Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes." International journal of pharmaceutics 417.1-2 (2011): 32-47.
(8)Heinz, Andrea, et al. "Quantifying ternary mixtures of different solid-state forms of indomethacin by Raman and near-infrared spectroscopy." European Journal of Pharmaceutical Sciences 32.3 (2007): 182-192.
(9)Rossi, Barbara, et al. "Vibrational properties of inclusion complexes: the case of indomethacin-cyclodextrin." The Journal of chemical physics 125.4 (2006): 044511.
(10)Inoue, Motoki, et al. "In situ monitoring of crystalline transformation of carbamazepine using probe-type low-frequency Raman spectroscopy." Organic Process Research & Development 21.2 (2017): 262-265.
(11)Hédoux, Alain, et al. "Polymorphic transformation of anhydrous caffeine upon grinding and hydrostatic pressurizing analyzed by low-frequency raman spectroscopy." Journal of pharmaceutical sciences 102.1 (2013): 162-170.
(12)Hisada, Hiroshi, et al. "Determining the distribution of active pharmaceutical ingredients in combination tablets using near IR and low-frequency Raman spectroscopy imaging." Chemical and Pharmaceutical Bulletin 68.2 (2020): 155-160.
(13)Piqueras, S., et al. "Monitoring polymorphic transformations by using in situ Raman hyperspectral imaging and image multiset analysis." Analytica chimica acta 819 (2014): 15-25.
(14)Larkin, Peter J., et al. "Polymorph characterization of active pharmaceutical ingredients (APIs) using low-frequency Raman spectroscopy." Applied Spectroscopy 68.7 (2014): 758-776.
関連記事
-
2023.02.10
フリッカーの測定によるLED照明の改善
-
2023.02.10
自動車の研究開発における色計測と白色点調整
-
2021.04.01
Wasatch Photonics社製 光源一体・高感度・小型ラマン分光器に関する最新技術情報
-
2023.02.10
分光器の中はどうなっているの?
-
2023.02.08
要求が厳しいディスプレイ向けの色彩輝度計Prometheus
-
2024.12.27
視野角測定機Conometer80とコノスコープレンズの測定結果の相関について
-
2023.02.08
分光放射計Neoを用いた透明な構造物の半球状の光透過の標準化測定方法
-
2023.05.08
ガルバノスキャナの特長と役割 ~最先端産業・研究を支える縁の下の力持ち~
![ティー・イー・エム[T.E.M. Incorporated]](/control/img/logo.png)





