技術情報
2025.12.08
加工・計測・分析
テーマ:
ラマン分光 × LFIA で「現場即診断」を実現 ― 薬物性肝障害(DILI)の迅速スクリーニングに成功
最新の研究により、紙ベースの簡易検査(LFIA)に携帯型ラマン分光器(wasatch Photonics XSシリーズ)を組み合わせた「SERS-LFIA」が、救急医療など臨床現場での薬物性肝障害の早期発見に十分な精度で使えることが示されました。本技術は「高感度・高精度・迅速・簡便」を兼ね備える、新時代の現場即診断プラットフォームです。
出典:表面増強ラマン散乱ラテラルフロー免疫測定法を用いた薬剤誘発性肝障害のPOC診断
A point-of-care diagnostic for drug-induced liver injury using surface-enhanced Raman scattering lateral flow immunoassay
Sian Sloan-Dennison, Kathleen M. Scullion, Benjamin Clark, Paul Fineran, Joanne Mair, Stacey Laing, Neil C. Shand, Cicely Rathmell, David Creasey, Dieter Bingemann, Jonathan Faircloth, Mark Zieg, Elizabeth Varghese, Christopher J. Weir, James W. Dear, Karen Faulds & Duncan Graham
背景:なぜ今、現場即診断が求められているか
鎮痛薬パラセタモール(アセトアミノフェン)の過剰摂取は、急性肝不全など重篤な肝障害を引き起こす世界的な問題です。こうした薬物性肝障害(DILI)で命に関わる治療を行うには、服用からできるだけ早く治療を開始する必要があります。
従来の肝機能検査では、バイオマーカーの変化速度の遅さや、正確な定量の反面、高度な技術と高価な材料を用いても結果が出るまで時間がかかることなどから、救急現場での迅速な判断には向いていません。
→ つまり、「現場で使える、簡易かつ信頼性の高いスクリーニング検査」のニーズが非常に高まっていました。
新技術の概要 ― SERS-LFIA + 携帯型ラマンリーダー
本研究では、血中のバイオマーカーである Cytokeratin-18(K18)を検出対象としました。K18は肝細胞の損傷や死を反映する有望なマーカーで、従来の ALT より早期に異常をとらえることが可能とされています。
検査は、紙ベースの免疫測定キット(Lateral Flow Immunoassay; LFIA)と、表面増強ラマン散乱(Surface-Enhanced Raman Scattering; SERS)を組み合わせたものです。
この組み合わせは様々なバイオマーカーの低濃度を検出するために使用されていますが、顕微鏡に取り付けられた大型のベンチトップラマン分光器で分析されています。
本研究では、専用の小型・携帯型ラマンリーダー(Handheld Raman Reader; HRR)を用いることで、「研究室の専用装置」ではなく、「病院の救急外来、クリニック、POC(Point-of-Care)現場」で実用可能な形にしています。
サンプル(血清)をカセットにかけ、20–30分後に HRR で測定すれば、定量的な K18 濃度を即時に得られます。視覚による「陽性/陰性判定」だけでなく、数値データとして扱えるのが大きな特長です。
図1:Pre-clinical SERS-LFIA development.
出典:A point-of-care diagnostic for drug-induced liver injury using surface-enhanced Raman scattering lateral flow immunoassay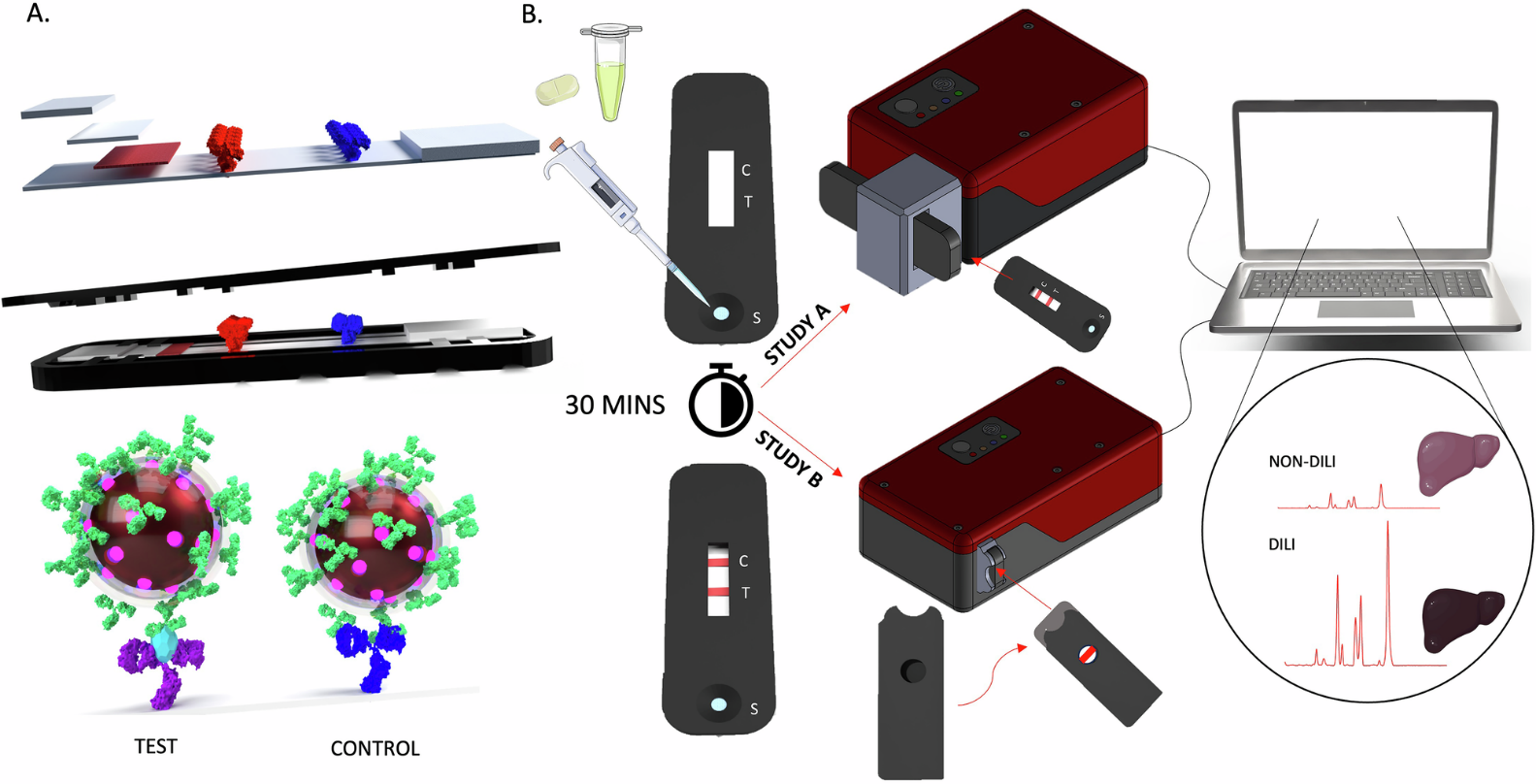
"A. SERS-LFIAストリップの構造を示す模式図。テスト(赤)とコントロール(青)の抗体ラインの位置、3Dプリントカセットに収納されたストリップ、K18が存在する場合にテストおよびコントロールライン上に形成される免疫アッセイを示しています。
B. SERS-LFIAの手順。患者から採取した血清をランニングバッファーで希釈し、カセットのサンプルポートにピペットで移しました。検査は20分間実行され、HRRで分析されます。"
図にはServier Medical Artから改変されたイラストが含まれており、Creative Commons Attribution 4.0 International License(CC BY 4.0)に基づいてライセンスされています。
実証データ ― 臨床評価で十分な診断性能を確認
病院でのレーザー使用の安全のために、実質的なレーザークラス1レベルとし、HRRは低出力化し、LFIAインターフェイスと光学系が最適化されました。
この SERS-LFIA + HRR による検査は、過去に薬物過剰服用した患者 199 検体を対象に評価されました。結果、 感度(肝障害ありを見逃さない率)約 82% / 特異度(肝障害なしを誤判定しない率)約 94% を達成しています。
図 2: 臨床サンプルに使用するためのハンドヘルド ラマン リーダー (HRR) と組み合わせた LFIA の開発。
出典:A point-of-care diagnostic for drug-induced liver injury using surface-enhanced Raman scattering lateral flow immunoassay
A臨床的に関連する濃度で血清サンプルを添加して作成した LFIA 較正曲線の代表画像。B較正曲線の代表 SERS スペクトル。HRR 4A を使用して、785 nm レーザー励起、3.5 mW レーザー出力、1 秒の取得、5 回のスキャン平均で収集した SERS スペクトル。C 3人の独立したドナーを使用した較正曲線の SERS 勾配。D M65 ELISA および LFIA で測定したK18濃度。SERS は平均値として示されています。
図3:POD後の患者血清サンプルを用いた臨床試験AおよびBのデータ
出典:A point-of-care diagnostic for drug-induced liver injury using surface-enhanced Raman scattering lateral flow immunoassay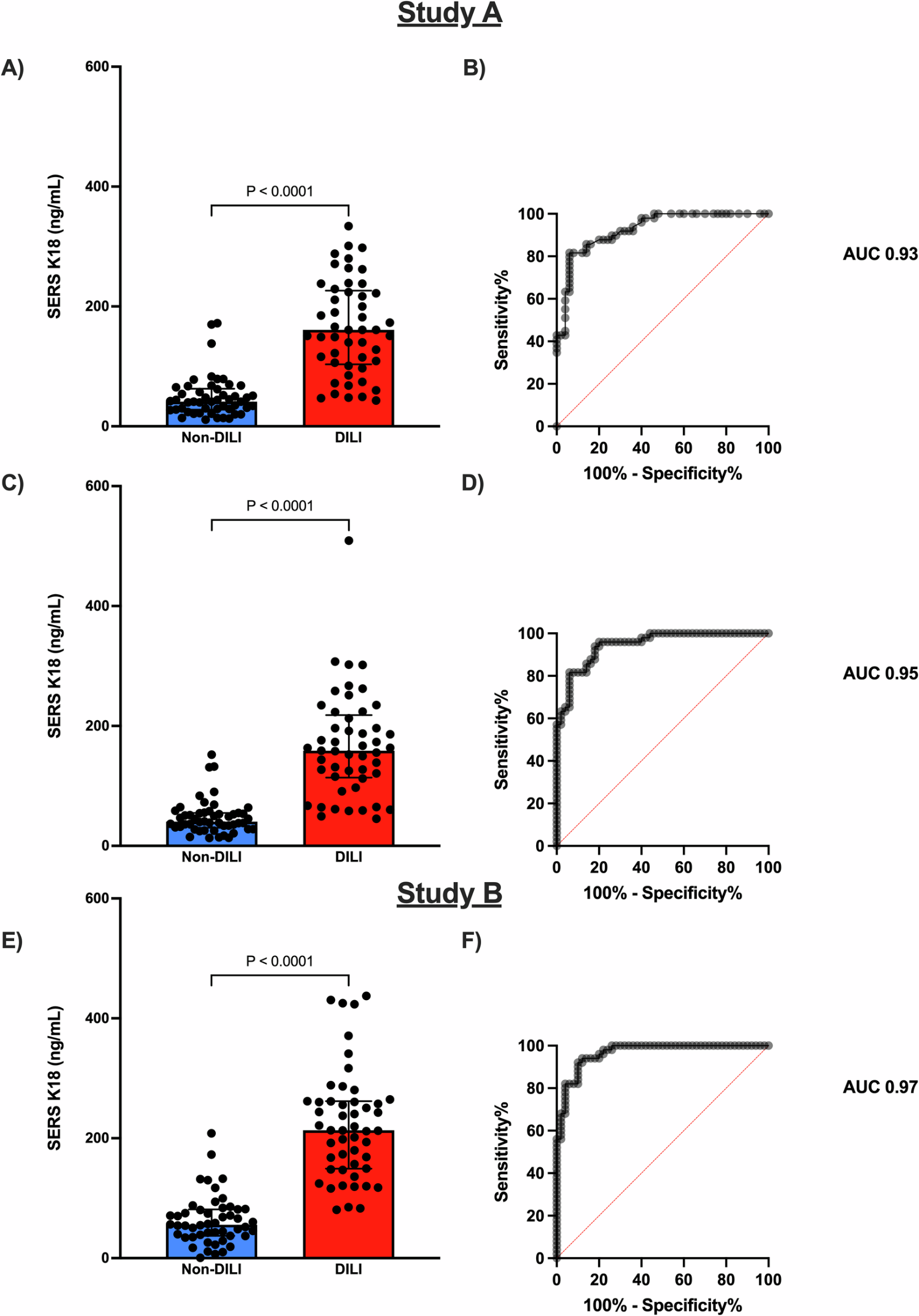 研究A—3台の分析装置からランダムに選択された最初の値を用いた主要な統計出力。Bは対応するROC曲線。C研究A—3台の分析装置の幾何平均データポイント。Dは対応するROC曲線。E 研究Bで評価された診断の改良版。分析装置の平均データポイント。Fは対応するROC曲線。バーは中央値±四分位範囲を表す。P値は両側マン・ホイットニー検定に基づき、P < 0.0001。
研究A—3台の分析装置からランダムに選択された最初の値を用いた主要な統計出力。Bは対応するROC曲線。C研究A—3台の分析装置の幾何平均データポイント。Dは対応するROC曲線。E 研究Bで評価された診断の改良版。分析装置の平均データポイント。Fは対応するROC曲線。バーは中央値±四分位範囲を表す。P値は両側マン・ホイットニー検定に基づき、P < 0.0001。
この性能は、現在の臨床試験や ELISA による K18 測定の報告値と同等かそれ以上でありながら、「検査から結果まで30分以内・現場で実施可能」という大きなメリットがあります。
この技術は「救急外来やPOC環境で肝障害ハイリスク患者を早期にスクリーニングし、適切な治療を迅速に開始できる」ツールとして実用レベルにあることが示されました。
将来展望 — “肝障害診断”を超えた汎用診断プラットフォームへ
本研究では K18 を対象にしましたが、SERS-LFIA は他のバイオマーカー — 例えば感染症マーカー、腫瘍マーカー、心臓疾患マーカーなどにも応用可能です。複数マーカーを同時に測定するマルチプレックス検査や、少量血液(将来的には指先血など)への対応など、応用範囲は広く期待されています。 Nature+1
また、POC(現場)、遠隔地医療、健診センター、在宅医療など、「ラボ設備が限られる環境」でも「高精度かつ定量的なバイオマーカー検査」が可能になることで、医療アクセスの改善、新しい診断市場の創出に寄与できる可能性があります。
このように、今回の成果は「単なる論文報告」ではなく、「将来の医療診断の形を変える可能性を秘めたプラットフォーム技術の実証」と言えます。
※本記事は、論文「A point-of-care diagnostic for drug-induced liver injury using surface-enhanced Raman scattering lateral flow immunoassay」の紹介を目的に、引用し、作成しています。
関連記事
-
2023.05.08
ガルバノスキャナの特長と役割 ~最先端産業・研究を支える縁の下の力持ち~
-
2021.04.07
REVIBRO社製高速フォーカシングMEMSミラーに関する技術情報
-
2022.06.27
輝度計の代用(相対輝度値の測定:IDS社製カメラ)
-
2021.06.03
アキシコンペアを用いたベッセルビーム生成による焦点スポットサイズと焦点深度の最適化
-
2023.06.12
医療技術における高精度マイクロオプティクス
-
2019.10.15
反射防止膜(ARコート)付き光ファイバーの利点
-
2019.09.05
OOFELIE:: MultiphisicsとZemax OpticStudioの連携
-
2020.05.13
レポートの生成機能について
- 人気記事

